|
|
|
БИОЛОГИЯ ПОЧВ |
МЕТОДЫ ИССЛЕДОВАНИЯ ПОЧВЕННОЙ БИОТЫ
|
Смотрите также:
Мейен - Из истории растительных династий
Биографии биологов, почвоведов
|
Населяющие почву организмы разнообразны по размерам, трофическим связям, образу жизни, таксономической принадлежности. Это обусловливает разнообразие методов, применяемых для исследования почвенной биоты. Помимо методов, заимствованных из зоологии, ботаники, альгологии, существуют и специальные методы для исследования почвенных организмов, учитывающие особенности почвы как среды обитания. Экологические методы рассматриваются в разделе, посвященном экологическим аспектам биологии почв.
ОСНОВНЫЕ ПРИЕМЫ АНАЛИЗА ПОЧВЕННЫХ МИКРООРГАНИЗМОВ
Для изучения представителей микроскопического мира, населяющих почву, существуют общие микробиологические приемы. Для исследования отдельных групп почвенных микроорганизмов применяют специальные методы.
Подготовка питательных сред
По составу все питательные среды делятся на естественные и синтетические. Естественные питательные среды — это молоко, кусочки вареного белка куриного яйца, сыворотка крови, овощи, фрукты и их отвары, отвары и гидролизаты мяса, рыбы, дрожжей. Для выращивания многих почвенных бактерий используют мясо-пеп- тонные среды, приготовляемые с добавлением пептона и поваренной соли к отварам и экстрактам мяса. Для выращивания грибов, дрожжей и некоторых бактерий используют виноградное или солодовое сусло. Последнее готовится из ячменного солода, содержит в качестве основного источника урлерода мальтозу, а также азотистые вещества и витамины. Естественными средами для изучения микроорганизмов почвы являются почвенные среды. Основой для их приготовления обычно служат торф, почва. Существует ряд способов использования почвы для питательных сред — приготовление пластинок из почвы с добавлением некоторых веществ, добавление экстрактов почвы в пита- тельные среды.
Синтетические питательные среды содержат определенный набор химических веществ, главные составные части сред точно известны. Для автотрофных микроорганизмов используют среды, состоящие из неорганических солей. Для культивирования гетеротро- фов в синтетические среды добавляют индивидуальные органические вещества: глюкозу, сахарозу, крахмал, клетчатку.
Особое место в изучении почвенных микроорганизмов занимают элективные среды, введенные в практику микробиологических исследований С. Н. Виноградским. Они обеспечивают развитие группы микроорганизмов, выполняющих определенную функцию, например, фиксирующих азот воздуха, разлагающих целлюлозу и т. д. Элективные среды далеко не всегда обеспечивают оптимальное развитие микроорганизмов, которые преимущественно на них растут.
По физическому состоянию среды разделяются на жидкие и плотные. Для получения плотных сред используют желатину (20%), агар-агар (2%), силикагель (кремнекислый гель). Силикагель представляет собой чисто минеральную основу для приготовления сред, пригодных для культивирования автотрофов.
Основные принципы стерилизации При работе с микроорганизмами необходимо, чтобы посуда и среды не содержали микробов, т. е. были стерильными. Для достижения стерильности микроорганизмы убивают нагреванием, ядовитыми веществами или удаляют их фильтрованием.
К числу обычно применяемых методов стерилизации относятся следующие: 1) термическая стерилизация — влажный жар (автоклавирова- ние), дробная стерилизация (тиндализация), неполная стерилизация или пастеризация; сухой жар — стерилизация с помощью горячего воздуха; прокаливание в пламени; 2) стерилизация фильтрованием; 3) стерилизация с помощью различных химических веществ; 4) облучение ультрафиолетом; 5) облучение улучами. Термическая влажная стерилизация основана на том, что микроорганизмы, как правило, очень чувствительны к действию влажного жара.
Автоклавирование включает в себя прогревание материалов в герметической камере чистым насыщенным паром при давлении выше атмосферного. Обычно среды стерилизуют автоклавированием при добавочном давлении (121°) в течение 20 мин. Среды, содержащие некоторые сахара, соки, молоко, стерилизуют при 112° 30 мин. Почву стерилизуют в увлажненном состоянии при 180е в течение 3 ч. Для сред, портящихся при температуре выше 100°, применяют стерилизацию текучим паром. Это дробная стерилизация (тиндализация) в кипятильнике Коха. Среды обрабатывают в аппарате Коха троекратно по 30— 40 мин 3 дня подряд.
Пастеризация — неполная стерилизация — достигается выдерживанием материала при 70° в течение 15 мин или при 80° — 10 мин и применяется для стерилизации легко портящихся пищевых продуктов (молоко, соки, сиропы), используемых в качестве питательных сред для микроорганизмов, а также освобождения почвенных суспензий от вегетативных клеток микроорганизмов.
Стерилизация сухим жаром применяется при обработке стеклянной посуды и других термоустойчивых материалов. Стерилизация проводится в сушильных шкафах при температуре 160° в течение 2—3 ч.
Прокаливанием в пламени стерилизуют металлические и стеклянные предметы: иглы, петли, предметные и покровные стекла, горлышки колб, бутылок, пробирок.
Стерилизация фильтрованием основана на способности фильтров адсорбировать микробные клетки. В настоящее время используют три типа фильтров: 1) мембранные фильтры (пористые диски, изготовляемые из эфиров целлюлозы); 2) фильтры Зейтца (диски, изготовляехМые из смеси асбеста с целлюлозой); 3) мелкопористые стеклянные фильтры (диски, изготовленные из фрагментов стекла путем их сплавления).
Химические дезинфицирующие средства используют для стерилизации использованных материалов и уничтожения патогенных микробов. Среды и посуду не стерилизуют с помощью химических агентов, так как их трудно удалить из стерилизуемых материалов. Используют нелетучие и летучие дезинфицирующие средства, такие как лизол и другие фенольные соединений, гипохлорид, формальдегид, окись этилена, хлороформ и другие. Одним из видов химической обработки может считаться частичная стерилизация с помощью антибиотиков. Ее используют, если стремятся освободиться от одних микроорганизмов и сохранить другие.' Для этого растворенный антибиотик добавляют в питательную среду или вносят в посевной материал. Этим приемом часто пользуются для выделения из почвы определенных групп микроорганизмов.
Воздействие ультрафиолетовыми лучами чаще всего применяют при стерилизации лабораторных боксов и столов. При действии на микроорганизмы в определенных дозах ультрафиолетовые лучи вызывают гибель последних. Наиболее эффективны лучи с длиной волны 2600 А. В качестве источника ультрафиолетового излучения обычно используют специальные кварцевые бактерицидные лампы. Излучателем в этих лампах служит электрическая дуга, возникающая в парах ртути низкого давления.
Облучение гамма-лучами используют для стерилизации воздушно- сухих образцов почвы. В почвенных исследованиях способ стерилиза- дии облучением признан наиболее надежным и мягким, не вызывающим образования токсических веществ, почти не влияющим на почвенный гумус и физико-химические свойства почвы. Облучение проводят в двойных герметически запаянных полиэтиленовых пакетах (10x10), содержащих 10—20 г почвы, на универсальной кобальтовой установке К—200 000; мощность облучения 0,5 Мрад/ч. Облучение проводят до получения общей дозы 2 Мрад.
Принципы работы с оптическим микроскопом
При работе с микроскопом необходимо придерживаться определенных правил и прежде всего правильно устанавливать освещение.
Установка света по методу Келера отвечает требованиям, предъявляемым к микроскопии. Она осуществляется при помощи точечного источника света, который дают специальные осветители — ОИ-7, ОИ-9, ОИ-18, ОИ-19. Порядок установки освещения следующий. Закрывают ирисовую диафрагму конденсора и полевую диафрагму осветителя. Устанавливают лампу осветителя в такое положение, чтобы изображение нити лампы было четким на диафрагме конденсора, которую оно должно полностью перекрывать. Наблюдение за изображением лити лампы на диафрагме конденсора осуществляют с помощью плоского зеркала микроскопа, в котором отражается диафрагма. Открывают ирисовую диафрагму конденсора и почти до предела закрывают диафрагму осветителя. Фокусируют объектив малого увеличения на плоскость объекта и находят изображение полевой диафрагмы осветителя в виде яркого светящегося круглого пятна. Затем, смотря в микроскоп, устанавливают конденсор в таком положении, при котором изображение светового пятна будет наиболее четким. После этого, не трогая больше конденсор, расширяют диафрагму осветителя до тех пор, пока ее края не совпадут с краями поля зрения. Диафрагму конденсора открывают на 2/3, меняя степень ее раскрытия при переходе от одного увеличения к другому.
При наблюдении в оптическом микроскопе обычно пользуются препаратами «раздавленная капля» или «висячая капля». Препарат «раздавленная капля» готовят следующим образом. На чистое предметное стекло наносят пипеткой каплю водопроводной воды или физиологического раствора (0,5% NaCi). Рядом с каплей петлей наносят исследуемый материал (клетки микробов). Петлю прожигают в пламени горелки, а каплю со штрихом исследуемого материала покрывают покровным стеклом. Следует при этом обращать внимание на то, чтобы в препарате не было излишней жидкости, которую отсасывают из-под стекла фильтровальной бумагой. Такие препараты рассматривают под микроскопом с сухими системами объектов (объектив 8Х и 40Х) и с иммерсией (объектив 90Х).
Препарат «висячая капля» готовят нанесением иглой на стерильное покровное стекло очень маленькой капли жидкости со взвешенными в ней клетками микроорганизмов. Стекло тотчас же переворачивают каплей вниз и помещают на специальное предметное стекло с лункой так, чтобы капелька висела над лункой, не касаясь ее краев и дна. Края лунки предварительно смазывают смесью равных частей вазелина и жидкого парафина, и покровное стекло крепко прижимают к предметному стеклу. Препарат просматривают с сухими системами объективов и с иммерсией. Наблюдения можно производить длительно — в течение недели и более. При приготовлении препаратов для длительных наблюдений пользуются не водой, а жидкой питательной средой. Препараты можно помещать на электрический нагревательный столик и следить за развитием микроорганизмов.
Обнаружение и учет численности микроорганизмов в почвах методом посева на плотные питательные среды
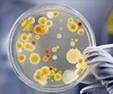
Метод посева — один из наиболее распространенных в практике исследования численности, группового и в некоторых случаях видового- состава микроорганизмов в почве. На чашках получают отдельные колонии микроорганизмов, число которых можно подсчитать, из них можно выделять микроорганизмы в чистые культуры для дальнейшега исследования и идентификации.
Образцы почв отбирают в стерильные пергаментные пакеты. С пробной площади можно брать три или пять образцов и анализировать их отдельно, либо составлять средний почвенный образец смешиванием трех-семи индивидуальных проб весом в 100—200 г. Образцы обычно берут по диагонали участка или «конвертом». Микробиологические исследования должны быть сделаны в день взятия образцов, так как при хранении влажных образцов состав микроорганизмов в них очень изменяется. При невозможности проведения анализа в ближайшие сутки прибегают к высушиванию образцов при температуре не выше 30°.
Техника проведения посева из почвы. Перед посевом влажную или сухую хорошо перемешанную почву высыпают на стекло, которое предварительно протирают спиртом, и тщательно перемешивают, освобождая от посторонних включений. Отвешивают 10 г почвы и пере- носят навеску в колбу со 100 мл стерильной водопроводной воды. Для разрушения почвенных агрегатов и десорбции клеток микроорганизмов^ применяют различные способы обработки почвенных образцов перед посевом по Звягинцеву: 1) 10-минутное ручное перемешивание почвенной суспензии в колбах; 2) растирание почвы, увлажненной да пастообразного состояния в течение 5 мин в стерильной фарфоровой чашечке резиновым пестиком или пальцем в резиновой перчатке. Увлажнение почвы следует производить водой или диспергирующим раствором. В зависимости от типа почвы и группы исследуемых микроорганизмов целесообразно применять те или иные диспергаторы. Например, для растирания дерново-подзолистой почвы лучше использовать воду; для черноземов и темно-каштановых почв — 0,03— 0,05%-ные растворы акилсульфатов синтетических спиртов; для красноземов — 0,1%-ный раствор пирофосфата натрия; 3) обработка почвенной суспензии на электрической пропеллерной мешалке в течение 5—10 мин; 4) обработка почвенной суспензии ультразвуком на установке УЗДН-1 в течение 3 мин. Для выделения бактерий и дрожжей можно использовать все перечисленные методы; наиболее эффективна обработка почвенных образцов ультразвуком. Для выделения и количественного учета грибов применяют только первые три перечисленных выше метода.
Посев почвенной суспензии на плотные среды производят из разведений 1 : 10; 1 : 100; 1 : 1000 и т. д. в зависимости от численности учитываемых микроорганизмов, типа почвы, ее влажности и т. д. В случае засева плотных сред разведение .подбирают таким образом, чтобы на чашке развивалось 50—200 колоний бактерий и актиномицетов и 30—50 колоний грибов ( 38). При слишком густом или разреженном посеве подсчет количества микроорганизмов будет очень неточным. Из каждого образца почвы берут не менее 3—5 повторных навесок и каждую высевают на 3—5 чашек с различными средами. Для выделения и учета различных групп почвенных микроорганизмов используют специальные среды, состав которых приводится в соответствующих разделах.
Разливку питательной среды в чашке Петри лучше производить, когда она имеет температуру около 50°, так как при этом на крышке чашек не образуется капель воды в результате конденсации пара. После застывания агара чашки помещают в сушильный шкаф и подсушивают при температуре 70—80° до появления на поверхности агара муарового рисунка. Это свидетельствует о том, что пленка воды с поверхности агара удалена и при размножении на ней колонии бактерий не будут расплываться.
На поверхность застывшей и подсушенной среды наносят каплю почвенной суспензии определенного разведения и с помощью стеклянного шпателя распределяют ее по всему агару. Засеянные чашки подписывают, переворачивают вверх дном и помещают в термостат при соответствующей температуре. Сроки учета микроорганизмов зависят от состава питательной среды и группы учитываемых микроорганизмов. На МПА обычно на 2—3 сут роста учитывают споровые и неспоровые формы бактерий. На среде Чапека через 5—7 сут роста учитывают колонии актиномииетов и бактерий, на сусло-агаре — на 5— 7 сут роста — колонии грибов и дрожжей.
Подсчет количества колоний на чашке проводят обычно со дна чашки в проходящем свете. На месте подсчитанной колонии чернилами по стеклу ставят точки. Для удобства подсчета чашку можно разделить на квадраты или секторы и в них подсчитывать количество колоний. В случае использования непрозрачных сред (например, почвенного агара) подсчет производят с поверхности агара.
Подсчитав количество колоний на всех параллельных чашках, вычисляют среднее их число на одной Ч'ашке и затем делают пересчет для определения содержания микроорганизмов в 1 г свежей почвы по1 формуле: а = б-в-г, где а — количество клеток в 1 г свежей почвы, б — среднее количество колоний на чашке, в — разведение, из которого сделан посев, г — количество капель в 1 мл суспензии.
|
|
|
|
К содержанию книги: И. П. БАБЬЕВА, Г. М. ЗЕНОВА, Д.Г.ЗВЯГИНЦЕВ
|
Последние добавления:
Вильямс. Травопольная система земледелия
Качинский - Жизнь и свойства почвы
Вернадский - химическое строение биосферы